
La partida ya ha comenzado y cada movimiento cuenta…
Si no se toman medidas urgentes, se estima que en 2050 la AMR podría desbancar al cáncer como primera causa de muerte.1

AMR: carga y epidemiología
La rápida aparición de bacterias resistentes a nivel global está poniendo en peligro la eficacia de los antibióticos, que han transformado la medicina y salvado millones de vidas.1-3
En 1928, cuando cualquier infección podría ocasionar la muerte, Alexander Fleming descubrió la penicilina, cambiando así el curso de la medicina. Sin embargo, décadas más tarde, la rápida propagación de la resistencia antimicrobiana (AMR) ha hecho que las infecciones bacterianas se hayan vuelto a convertir en un gran desafío para la medicina.1-3 De hecho, la AMR es reconocida por la Organización Mundial de la Salud (OMS) como una de las 10 principales amenazas de salud pública a las que se enfrente la humanidad.4
La resistencia a antibióticos es un proceso evolutivo natural de las bacterias a través del cual algunas de las bacterias que causan infecciones sobreviven a la exposición a antibióticos que normalmente las matarían o inhibirían su crecimiento.5 Las bacterias resistentes que sobreviven se multiplican y se extienden con mayor rapidez debido a la disminución de la competición con otras bacterias que sí son sensibles al antibiótico y, por tanto, han desaparecido. 5
 La AMR causa
700.000 muertes
cada año5
La AMR causa
700.000 muertes
cada año5
Estas bacterias resistentes pueden propagarse entre personas o entre personas y animales, especialmente a partir de alimentos de origen animal.4 Las bacterias resistentes se propagan rápidamente gracias al desarrollo de nuevos mecanismos de evasión, comprometiendo la capacidad para tratar infecciones comunes.4-6
Aunque la AMR es un proceso natural, existen diferentes factores que favorecen la aparición de la AMR:1,4
-
Uso indebido y excesivo de antibióticos
-
Falta de acceso a agua limpia, saneamiento e higiene tanto para las personas como los animales
-
Medidas deficientes de prevención y control de las enfermedades en centro de salud y explotaciones agrícolas
-
Acceso deficiente a medicamentos, vacunas y medios de diagnóstico asequibles y de calidad
-
Falta de sensibilización y conocimiento
En Europa se ha producido un aumento de las infecciones por bacterias resistentes a los antibióticos, con más de 670.000 casos estimados de infecciones anuales, y con la resistencia a carbapenémicos representando una amenaza creciente en la UE en todos los patógenos. Los porcentajes de resistencia a carbapenémicos varían entre los países europeos, siendo más altos en los países del sur.7
+670.000
Infecciones por bacterias multirresistentes7
~33.000
Muertes/año por infecciones causadas por bacterias multirresistentes7
75%
están asociadas
a la atención sanitaria8
~40%
causadas por bacterias
resistentes a antibióticos
de último recurso
(carbapénemicos y colistina)8
~1.100 millones €
Costes aproximados
a los sistemas de salud europeos7
Su carga es comparable a la que suponen la suma de gripe, VIH/SIDA y tuberculosis8
Resistencia a antibióticos
Gripe
Tuberculosis
VIH/SIDA
 ONE HEALTH
“Una sola salud”
ONE HEALTH
“Una sola salud”
En 2017, la Comisión Europea adoptó el Plan de Acción One Health frente a la AMR con el fin de apoyar a la UE y sus estados miembros para alcanzar soluciones innovadoras, efectivas y sostenibles.7
Sus 3 pilares fundamentales de este Plan de Acción son:9
- Hacer de la UE una región modelo en materia de buenas prácticas
- Fomentar la investigación, el desarrollo y la innovación
- Configurar la agenda mundial
Sin embargo, la AMR tiene aun más importancia en España, pues la frecuencia de infecciones por bacterias resistentes es más elevada que en otros países de Europa.7,10

Plan Nacional frente a la Resistencia a los Antibióticos (PRAN)
Dentro de la estrategia común europea, se estimuló la puesta en marcha de planes nacionales en los que se encuentra el Plan Nacional frente a la Resistencia a los Antibióticos (PRAN), aprobado en 2015.12
El PRAN aborda la AMR desde 6 líneas estratégicas o de acción:15
-
Vigilancia del consumo y de la resistencia a los antibióticos
-
Control de la resistencia a antibióticos
-
Prevención
Medidas alternativas de prevención, diagnóstico y tratamiento -
Investigación para mejorar el conocimiento sobre la resistencia
-
Formación dirigida a los profesionales sanitarios
-
Comunicación
Campañas de concienciación para público general y específico
La AMR ha ido aumentando hasta convertirse en un problema global de salud pública para la prevención y el tratamiento de las enfermedades infecciosas.5
Sin una acción global armonizada e inmediata, el mundo se dirige a una era post-antibióticos en la que las infecciones comunes podrían volver a ser mortales.
– OMS, Plan de Acción Mundial sobre las AMR de 2015
Si no se toman medidas urgentes, se estima que en 2050 la AMR podría desbancar al cáncer como primera causa de muerte, con 100.000 millones de muertes.5
-
1ª
Causa de muerte,
desbancando al cáncer12 -
~12x
Muertes en Europa, alcanzando las 390.000 al año12
-
13x
Muertes en España, alcanzando las 40.000 al año12
AMR, resistencia antimicrobiana (por sus siglas en inglés); OMS, Organización Mundial de la Salud; PRAN, Plan Nacional frente a la Resistencia a los Antibióticos; SIDA, síndrome de la inmunodeficiencia humana adquirida; VIH, virus de la inmunodeficiencia humana.
Referencias: 1. Ventola CL. The antibiotic resistance crisis: part 1: causes and threats. PT. 2015;40(4):277-83; 2. Roope LSJ, Smith RD, Pouwels KB, et al. The challenge of antimicrobial resistance: What economics can contribute. Science. 2019; 364(6435):eaau4679; 3. Nielsen TB, Brass EP, Gilbert DN, et al. Sustainable Discovery and Development of Antibiotics - Is a Nonprofit Approach the Future? N Engl J Med. 2019; 381(6):503-505; 4. Organización Mundial de la Salud (OMS). Resistencia a los antimicrobianos. 13 octubre 2020. Disponible en: https://www.who.int/es/news-room/fact-sheets/detail/antimicrobial-resistance [Último acceso: noviembre 2021]; 5. Review on Antimicrobial Resistance. Tackling drug-resistance infections globally: final report and recommendations. The review on antimicrobial resistance. May 2016; 6. World Health Organization (WHO). Global antimicrobial resistance surveillance system (GLASS) report 2021. Geneva, 2021; 7. European Centre for Disease Prevention and Control. Antimicrobial resistance in the EU/EEA (EARS-Net) - Annual Epidemiological Report 2019. Stockholm: ECDC; 2020; 8. OECD. Antimicrobial Resistance Tackling the Burden in the European Union. 2019. Disponible en: https://www.oecd.org/health/health-systems/AMR-Tackling-the-Burden-in-the-EU-OECD-ECDC-Briefing-Note-2019.pdf [Último acceso: noviembre 2021]; 9. European Comission. A European One Health Action Plan against Antimicrobial Resistance (AMR). Disponible en: https://ec.europa.eu/health/sites/default/files/antimicrobial_resistance/docs/amr_2017_action-plan.pdf [Último acceso: noviembre 2021]; 10. Cantón R, Huarte R, Morata L, et al. Determining the burden of infectious diseases caused by carbapenem-resistant gram-negative bacteria in Spain. Enferm Infecc Microbiol Clin (Engl Ed). 2021;39(4):179-183; 11. ECDC. Consumption of Antibacterials for systemic use (ATC group J01) in the community (primary care sector) in Europe, reporting year 2019. Disponible en: https://www.ecdc.europa.eu/en/antimicrobial-consumption/database/rates-country [Último acceso: noviembre 2021]; 12. Ministerio de Sanidad, Consumo y Bienestar Social. Plan Nacional frente a la resistencia a los antibióticos 2019-2021. Disponible en: https://resistenciaantibioticos.es/es/system/files/field/files/pran_2019-2021_0.pdf?file=1&type=node&id=497&force=0 [Último acceso: noviembre 2021]; 13. Sociedad Española de Medicina Preventiva Salud Pública e Higiene. Estudio EPINE-EPPS nº 30: 2019. Informe España. Prevalencia de infecciones (relacionadas con la asistencia sanitaria y comunitarias) y uso de antimicrobianos en hospitales de agudos. Disponible en: https://epine.es/api/documento-publico/2019%20EPINE%20Informe%20Espa%C3%B1a%2027112019.pdf/reports-esp. [Último acceso: noviembre 2021]; 14. Informe de vigilancia 2018-2019. Encuesta de prevalencia de las IRAS y uso de antimicrobianos en los hospitales de España. Unidad de Vigilancia de las Infecciones Relacionadas con la Asistencia Sanitaria. Centro Nacional de Epidemiología (CNE). Instituto de Salud Carlos III (ISCIII). Madrid. España. 2021; 15. Plan Nacional Resistencia Antibióticos. ¿En qué trabaja el PRAN?. Disponible en: https://www.resistenciaantibioticos.es/es/lineas-de-accion [Último acceso: noviembre 2021]; 16. World Health Organization (WHO). Global Action Plan on Antimicrobial Resistance. Geneva, 2015.
Bacterias multirresistentes

La OMS ha reconocido la creciente amenaza de bacterias resistentes a antibióticos, insistiendo en la necesidad de abordar este problema lo antes posible para prevenir sus devastadoras consecuencias en la población.1
Por ello, publicó su primera la lista de patógenos prioritarios, para los cuales se requieren urgentemente nuevos antibióticos. Se dividen en 3 categorías:2
- Prioridad crítica
- Prioridad alta
- Prioridad media
Las bacterias de prioridad crítica incluye las bacterias multirresistentes que son especialmente peligrosas en hospitales, residencias y pacientes que necesitan dispositivos como ventiladores y catéteres intravenosos. Entre tales bacterias se incluyen las siguientes: Acinetobacter, Pseudomonas y varias enterobacteriaceas como Klebsiella, E. coli, Serratia, y Proteus. Son bacterias que pueden provocar infecciones graves y a menudo letales, como infecciones de el torrente sanguíneo y neumonías. Estas bacterias presentan gran resistencia a carbapenémicos y cefalosporinas de 3ª generación, los mejores antibióticos actualmente disponibles.3
Mientras, en las bacterias de prioridad alta y media se encuentran aquellas que presentan una resistencia a antibióticos creciente y provocan enfermedades comunes como la gonorrea o intoxicaciones alimentarias por Salmonella.3
Todos los patógenos de prioridad crítica son Gram negativas2
-
Acinetobacter baumannii resistentes a carbapenémicos
-
Pseudomonas aeruginosa resistentes a carbapenémicos
-
Enterobacteriaceae resistentes a carbapenémicos y resistentes a cefalosporinas de 3ª generación
Las bacterias Gram negativas resistentes a carbapenémicos (GNRC) constituyen una gran preocupación a nivel mundial debido a:4
- Rápida propagación
- Brotes graves
- Opciones terapéuticas limitadas
- Desarrollo de nuevas resistencias
Porcentaje de resistencia de las bacterias de prioridad crítica en España, 20195
77,1%
Acinetobacter baumannii resistentes a carbapenémicos
28,3%
Pseudomonas aeruginosa resistentes a carbapenémicos
6,3%
26,7%
Enterobacteriaceae
resistentes a carbapenémicos y resistentes a cefalosporinas de 3ª generación
En este contexto, en 2017, se llevó a cabo un estudio cuyo objetivo fue determinar la carga de las infecciones causadas por GNRC en España. Se consideraron 3 patógenos en este estudio: A. baumannii, P. aeruginosa y K. pneumoniae.4
89,3%
Prevalencia de infección nosocomial por
bacterias GNRC4
68,2% Infección por A. baumannii
37,8%
Mortalidad media por infecciones
GNRC por estos 3 patógenos4
57% Mortalidad por P. aeruginosa
471.591.266€ Costes totales de las infecciones GNRC4
En el estudio EPINE 2019 en España, las bacterias Gram-negativas representan más del 50% de las infecciones nosocomiales y casi el 50% de las infecciones comunitarias. Las bacterias GN aisladas más frecuentemente fueron:6
- E. Coli
- P. aeruginosa
- K. pneumoniae
AMR, resistencia antimicrobiana (por sus siglas en inglés); EPINE, Estudio de Prevalencia de las Infecciones Nosocomiales en España; GN, gram negativas; GNRC, gram negativas resistentes a carbapenémicos; OMS, Organización Mundial de la Salud.
Referencias: 1. World Health Organization (WHO). Global Action Plan on Antimicrobial Resistance. Geneva, 2015; 2. World Health Organization (WHO). Global priority list of antibiotic-resistant bacteria to guide research, discovery, and development of new antibiotics. Disponible en: https://www.who.int/medicines/publications/WHO-PPL-Short_Summary_25Feb-ET_NM_WHO.pdf [Último acceso: noviembre 2021]; 3. World Health Organization (WHO). News. WHO publishes list of bacteria for which new antibiotics are urgently needed. Disponible en: https://www.who.int/news/item/27-02-2017-who-publishes-list-of-bacteria-for-which-new-antibiotics-are-urgently-needed [Último acceso: noviembre 2021]; 4. Cantón R, Huarte R, Morata L, et al. Determining the burden of infectious diseases caused by carbapenem-resistant gram-negative bacteria in Spain. Enferm Infecc Microbiol Clin (Engl Ed). 2021;39(4):179-183; 5. Informe de vigilancia 2018-2019. Encuesta de prevalencia de las IRAS y uso de antimicrobianos en los hospitales de España. Unidad de Vigilancia de las Infecciones Relacionadas con la Asistencia Sanitaria. Centro Nacional de Epidemiología (CNE). Instituto de Salud Carlos III (ISCIII). Madrid. España. 2021; 6. Sociedad Española de Medicina Preventiva Salud Pública e Higiene. Estudio EPINE-EPPS nº 30: 2019. Informe España. Prevalencia de infecciones (relacionadas con la asistencia sanitaria y comunitarias) y uso de antimicrobianos en hospitales de agudos. Disponible en: https://epine.es/api/documento-publico/2019%20EPINE%20Informe%20Espa%C3%B1a%2027112019.pdf/reports-esp. [Último acceso: noviembre 2021].
Tratamiento temprano y adecuado
Como consecuencia de la resistencia a antimicrobianos, los antibióticos y otros medicamentos antimicrobianos se vuelven ineficaces y las infecciones son cada vez más difíciles o imposibles de tratar.1
Si los tratamientos actuales son cada vez más limitados, muchos de los procedimientos donde se requieren antibióticos de manera rutinaria como, por ejemplo: la quimioterapia, el trasplante de órganos o procedimientos quirúrgicos… supondrían un grave peligro para los pacientes, puesto que son más vulnerables a infecciones. 2
Por eso, es fundamental desarrollar nuevos tratamientos, puesto que un tratamiento tardío e ineficaz tiene consecuencias tanto clínicas como económicas:
Impacto en el resultado de los pacientes
Un tratamiento adecuado administrado de manera temprana mejora los resultados de los pacientes3
Descenso de la mortalidad con un tratamiento adecuado y temprano*3
64%
Pacientes con un tratamiento ineficaz o tardío3
29%
Pacientes con un tratamiento adecuado y temprano3
Duración del tratamiento y la estancia hospitalaria
El retraso en la administración de un tratamiento adecuado afecta a la duración tanto del tratamiento como de la estancia hospitalaria4
+4,5 días
Media de duración de tratamiento antibiótico de las infecciones graves causadas por patógenos resistentes a antibióticos*4
+4,9 días
Media de duración de la estancia hospitalaria de las infecciones graves causadas por patógenos resistentes a antibióticos *4
Costes hospitalarios
La media total de los costes hospitalarios aumenta con el retraso en la administración de un tratamiento adecuado en las infecciones graves debidas a patógenos resistentes a antibióticos en pacientes con infecciones por bacterias GN. Se ha observado un aumento de más del 55% en los costes hospitalarios debido al retraso en la administración de un tratamiento temprano.4
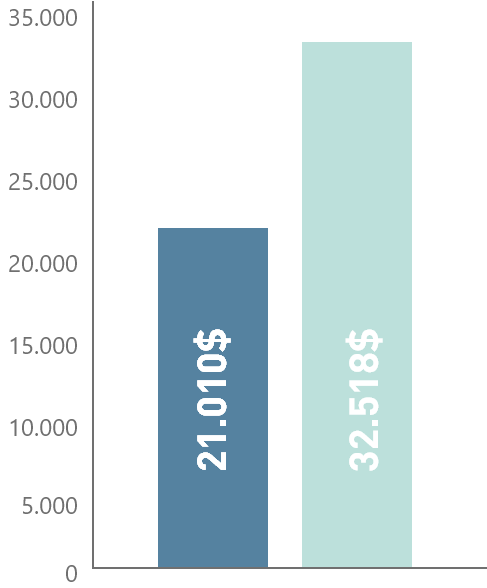
+55%
En los costes hospitalarios con el retraso en la administración de un tratamiento temprano4
Un tratamiento adecuado administrado de manera temprana puede ayudar a mejorar los resultados del paciente, reducir la tasa de mortalidad y la carga económica
Referencias: 1. World Health Organization (WHO). Fact sheets. Antimicrobial resistance. Disponible en: https://www.who.int/news-room/fact-sheets/detail/antimicrobial-resistance [Último acceso: noviembre 2021]; 2. Review on Antimicrobial Resistance. Tackling drug-resistance infections globally: final report and recommendations. The review on antimicrobial resistance. May 2016; 3. Falcone M, Bassetti M, Tiseo G, et al. Time to appropriate antibiotic therapy is a predictor of outcome in patients with bloodstream infection caused by KPC-producing Klebsiella pneumonia. Critical Care. 2020,24(29); 4. Bonine NG, Berger A, Altincatal A, et al. Impact of Delayed Appropriate Antibiotic Therapy on Patient Outcomes by Antibiotic Resistance Status From Serious Gram-negative Bacterial Infections. Am J Med Sci. 2019;357:103-110.
I+D: nuevos antibióticos
Se requieren urgentemente nuevos antibióticos, pues el pipeline actual es insuficiente para abordar el desafío creciente de las bacterias resistentes a antibióticos1
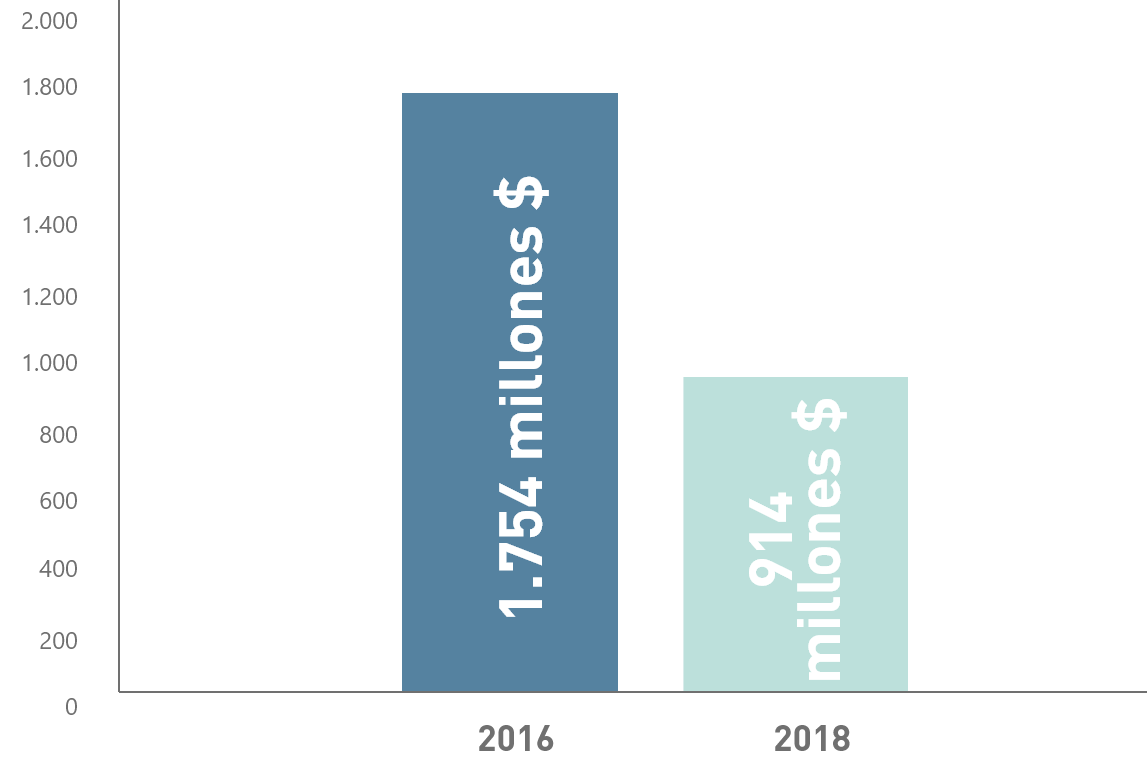
Se ha observado una reducción dramática de la inversión destinada al desarrollo de nuevos antibióticos desde 1980, tanto por parte de la industria como de la financiación pública 2
- Se ha visto como en las últimas décadas, el número de empresas farmacéuticas y biotecnológicas dedicadas a I+D de AMR ha disminuido significativamente2,3
Desde ese mismo año, no se ha aprobado ninguna nueva familia de antibióticos3
- Por ejemplo, el descubrimiento de nuevos antibióticos es cada vez más complejo que antes, especialmente para aquellas bacterias Gram negativas que causan una gran preocupación2
La inversión en I+D de nuevos antibióticos sigue disminuyendo cada año 3,4
A continuación, se definen los 3 pilares fundamentales para abordar el desafío de la AMR:5
1. Antibióticos efectivos y novedosos
2. Colaboración a gran escala
3. Procesos y plazos eficientes para la aprobación de antibióticos
Pipeline actual*1
- El pipeline actual contiene 43 antibióticos y combinaciones con una nueva entidad terapéutica y 27 agentes antibacterianos no tradicionales
- De los 43 antibióticos
-
- 60% (26/43) son activos frente a patógenos de prioridad definidos por la OMS
- De los 26 antibióticos que actúan sobre patógenos de prioridad definidos por la OMS, 50% (13/26) de estos son activos frente al menos uno de los patógenos Gram-negativos de prioridad crítica
- De los 27 agentes antibacterianos no tradicionales, 9 son anticuerpos, 4 bacteriófagos y enzimas derivadas de fagos, 8 agentes moduladores del microbioma, 2 agentes inmunomoduladores y 4 agentes diversos
- Desde 2017, solamente se han aprobado 11 nuevos antibióticos, de los cuales más del 80% pertenecen a clases ya existentes
43
Antibióticos en el pipeline actual1
60%(n=26/43)
Frente a patógenos de prioridad1
30%(n=13/43)**
Frente al menos un patógeno Gram-negativo de prioridad crítica1
11
Nuevos antibióticos aprobados desde el 20171
>80%
De los antibióticos aprobados más del 80% pertenecen a clases ya existentes1
Si la AMR sigue aumentando como se estima podremos llegar a un escenario extremadamente preocupante donde habremos agotado nuestro arsenal de antibióticos.6
Si no se toman medidas, la AMR a antibióticos de segunda línea será un 72% mayor en 2030 en comparación con 2005 en UE/EEE y la AMR a tratamientos de último recurso será más del doble6
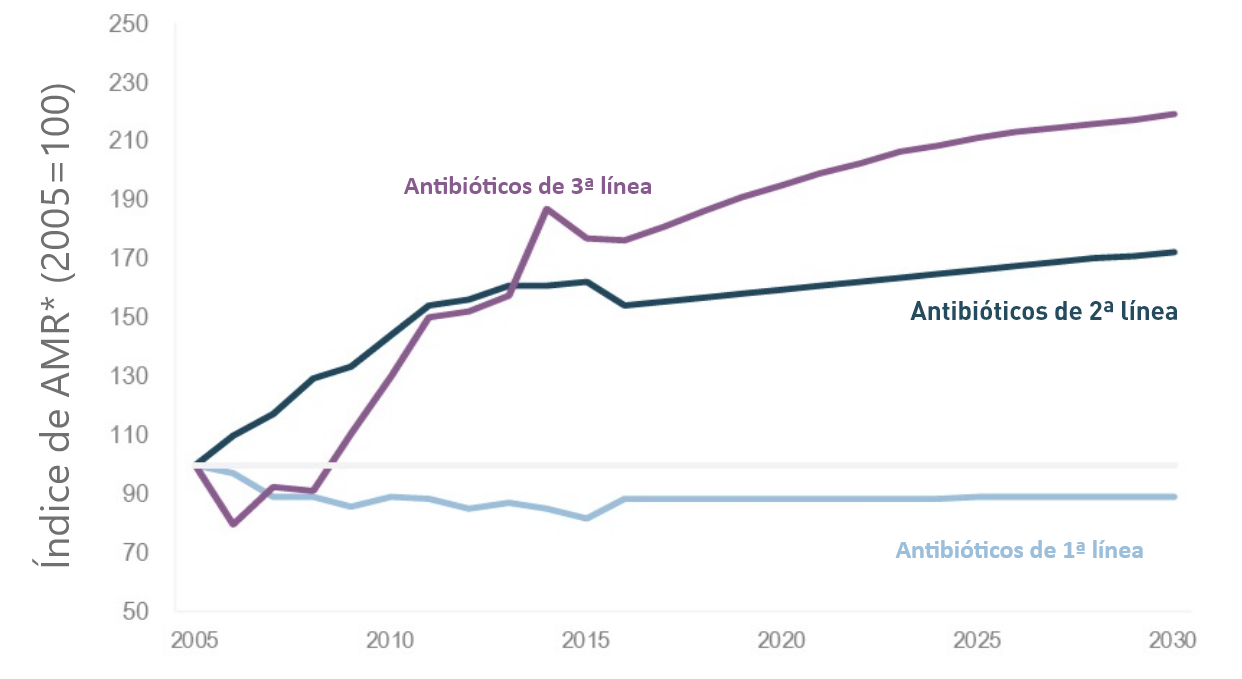
*Los datos se normalizaron con respecto a la resistencia media a los antimicrobianos en 2005 (igual a 100) para cada línea de tratamiento (por ejemplo, un valor de 172 para la resistencia a los tratamientos de segunda línea en 2015 en los países de la UE/EEE significa que la resistencia a los tratamientos de segunda línea es un 72% mayor que en 2005 en los países de la UE/EEE). En el informe de la OCDE, la AMR a los tratamientos de primera línea se definió como la media de los porcentajes de S. pneumoniae resistentes a la penicilina y SARM. La AMR a los tratamientos de segunda línea se definió como la media de los porcentajes de aislados de E. coli y K. pneumoniae resistentes a las cefalosporinas de tercera generación y de E. coli resistentes a las fluoroquinolonas. La AMR a los tratamientos de tercera línea se definió como el porcentaje de aislados de K. pneumoniae resistentes a los carbapenémicos.6
, resistencia antimicrobiana (por sus siglas en inglés); EEE, Espacio Económico Europeo; I+D, Investigación y Desarrollo; OCDE, Organización para la Cooperación y el Desarrollo Económicos; OMS, Organización Mundial de la Salud; SARM, Staphylococcus aureus resistente a la meticilina; UE, Unión Europea.
Referencias: 1. World Health Organization (WHO). 2020 Antibacterial agents in clinical and preclinical development: an overview and analysis. Geneva, 2021; 2. O’Neill J, et al. Tackling drug-resistant infections globally: Final report and recommendations. 2016. Disponible en: https://amr-review.org/sites/default/files/160518_Final%20paper_with%20cover.pdf [Último acceso: noviembre 2021]; 3. AMR Industry Alliance. 2020 progress report. January 2020. Disponible en: https://www.amrindustryalliance.org/wp-content/uploads/2020/01/AMR-2020-Progress-Report.pdf [Último acceso: noviembre 2021]; 4. AMR Industry Alliance. Tracking progress to address AMR. January 2018. Disponible en: https://www.amrindustryalliance.org/wp-content/uploads/2018/01/AMR_Industry_Alliance_Progress_Report_January2018.pdf [Último acceso: noviembre 2021]; 5. Boyd NK, Teng C, Frei CR. Brief Overview of Approaches and Challenges in New Antibiotic Development: A Focus On Drug Repurposing. Front Cell Infect Microbiol. 2021;11:684515; 6. OECD. Antimicrobial Resistance Tackling the Burden in the European Union. 2019. Disponible en: https://www.oecd.org/health/health-systems/AMR-Tackling-the-Burden-in-the-EU-OECD-ECDC-Briefing-Note-2019.pdf [Último acceso: noviembre 2021].

